Solutions acides et solutions basiques
Situation de départ
L'acidité du jus d'orange est inférieure à celle de jus de citron, on le distingue par le sens du goût.
- Existe-t-il un autre moyen de distinguer l'acidité de ces deux solutions ? Et comment distinguer l'acidité d'autres solutions aqueuses qui ne peuvent pas être goûtées ? Et quelles précautions faut-il prendre lors de l'utilisation de solutions aqueuses ?
1) Définition de pH
1-1) pH de la solution aqueuse
a) Définition d’une solution aqueuse :
- Une solution aqueuse est un mélange homogène obtenu en dissolvant un corps solide, liquide ou gazeux dans l’eau.
- Une solution est électriquement neutre, donc si elle contient des cations, elle va nécessairement contenir aussi des anions
- ◆ Solution chlorure de sodium (Na++ Cl-)
- ◆ Solution d'acide chlorhydrique (H++ Cl-)
- ◆ Solution de Sulfate de fer III (2Fe3++3SO42-)
b) Définition du pH de la solution aqueuse
- Le pH d’une solution aqueuse est un nombre sans unité compris entre 0 et 14. Il permet d’évaluer l’acidité ou la basicité de cette solution
- Le pH de la solution aqueuse est mesuré avec du papier pH ou un appareil du pH-mètre
1-2) Mesure du pH de la solution aqueuse :
a) Utilisation du papier pH :
Au cour de la combustion on observe :
- Papier pH : papier qui change de couleur selon le pH de la solution,
- Chaque couleur correspondant à un numéro inscrit sur la boite du papier pH déterminant la valeur de pH de la solution aqueuse.
b) Utilisation d'un PH-mètre :
- pH-mètre : appareil servant à identifier plus précisé la valeur de pH d'une solution aqueuse
- Les mesures faites avec un pH-mètre sont généralement plus précises par rapport ceux faites avec du papier pH.
1-3) Classification des solutions aqueuses :
On classe les solutions en trois types selon le pH :
- Solution acide : si le pH est inférieur à 7 (pH ˂ 7)
- Solution neutre : si le pH est égal à 7 (pH = 7)
- Solution basique : si le pH est supérieur à 7 (pH ˃ 7)
2) Dilution d’une solution aqueuse :
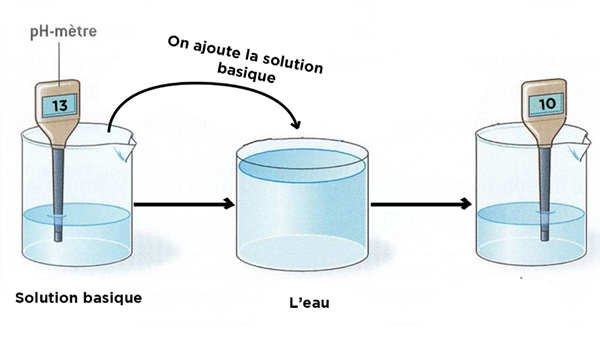
- Une dilution consiste à ajouter un volume déterminé d'une solution concentrée à un volume déterminé de l'eau distillée
- Lorsqu'on dilue une solution son pH se rapproche de 7.
Lorsqu'on dilue une solution acide son pH augmente et se rapproche de 7 : elle devient moins acide.
Lorsqu'on dilue une solution basique son pH diminue et se rapproche de 7 : elle devient moins acide.
3) Dangers des solutions acides ou basiques concentrées
Sur les étiquettes des produits chimiques figurent des pictogrammes de sécurité, permettant de connaître les dangers de ces produits.
Quelques précautions
- Ne surtout jamais sentir au-dessus d’un récipient contenant un acide ou une base.
- En cas de contact avec les yeux, il faut immédiatement et abondamment rincer sous l’eau.
- Il faut enfin, bien évidemment, ni le boire ni le mettre en contact avec la peau.
- Eviter de travailler avec de solutions concentrées
PDF إضغط في الأسفل لتحميل الدرس بصيغة